
A FDA alerta que a versão aprovada também pode causar danos à saúde, especialmente para quem tem problemas de fígado, ou se tomada com outros medicamentos, tais como alguns tipos de esteroides. Além disso, a combinação com álcool pode ser explosiva, explica Leonore Tiefer, professora da Escola de Medicina da Universidade de Nova York.
“O álcool é o mais sério de todos (os riscos), porque essa é uma droga que afeta o sistema nervoso central. O medicamento tem um efeito sedativo, as pessoas desmaiaram mesmo sem tomar álcool. Mas o álcool parece piorar esse problema.”
Outros especialistas são mais otimistas em relação ao novo remédio.
“A aprovação desse medicamento abre a porta para o desenvolvimento de outros produtos, para outras opções de tratamento. Isso abre a discussão entre a mulher e o clínico sobre o desejo sexual dela e dá um sinal às farmacêuticas que elas devem continuar desenvolvendo mais drogas como essa no futuro”, afirmou Leah Millheiser, da Universidade de Stanford.
Só para tratar transtornos
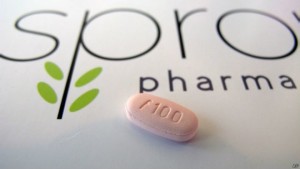
A Flibanserin, produzida pelo laboratório farmacêutico Sprout Pharmaceuticals, foi aprovada por um comitê da FDA por 18 votos a seis no último dia 4 de junho. A agência, no entanto, informou que a nova droga só deve ser ministrada ao tratamento de “transtornos de desejo sexual hipoativo (HSDD, na sigla em inglês)”. Dessa forma, um médico deverá determinar se a paciente sofre da doença, caracterizada pela falta de apetite sexual.
Atualmente, não há nenhuma droga aprovada no mercado americano para o tratamento da HSDD ou outra condição similar. “Essa condição é claramente uma área em que as necessidades médicas ainda não foram atendidas”, informou a FDA. Segundo o fabricante, o medicamento deve ser ingerido diariamente. Alguns médicos alertaram, no entanto, que seriam necessárias semanas para que sejam sentidos os primeiros benefícios da nova droga.
No informe, a FDA acrescentou que o tratamento deveria ser interrompido se não houver melhora após o fim de oito semanas. A CEO da Sprout, Cindy Whitehead, afirmou à agência de notícias Associated Press que promoveria o Addyi “com parcimônia”. “Não queremos que um paciente que não esteja tendo qualquer benefício tome o medicamento e diga a todo mundo que ele não funciona”, afirmou ela. A droga foi originalmente produzida pelo laboratório alemão Boehringer Ingelheim. A Sprout comprou a patente do medicamento depois de que ele foi rejeitado inicialmente pela FDA.
Fonte:
BBC
























Adicione Comentário